
術後

本院所刊檔案照片皆必須經過當事人同意,非當事人同意之檔案照片皆有完善保護程序
醫學美容微整型的興起,在於其方便快速的特性,微創式針劑快速塑型的效果,讓許多愛美女性趨之若鶩,而注射技術的應用更是佔據微整形市場相當大的比重~
隨著年齡的不斷增長,皮下脂肪以及膠原蛋白逐漸流失,讓我們的肌膚也逐漸無法抵抗地心引力的影響,老化下垂及皮膚皺褶悄悄的在臉上出現,醫美微整形技術可以透過玻尿酸填補方式讓外表對抗歲月痕跡:而針對先天臉型不佳亦可有微調修飾的效果。
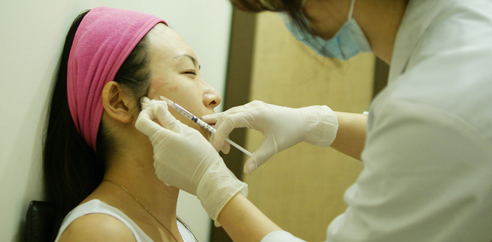
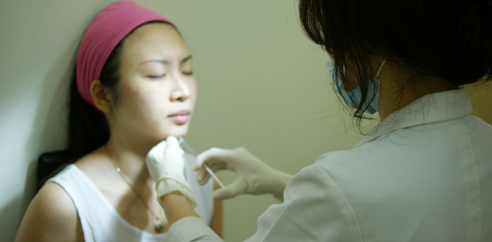
何玲嬅醫師治療前與小柔做詳細的評估及需求並討論所需劑量

輕熟女小柔因為對於自己的臉型不佳的問題來到診所,小柔表示她不喜歡拍照,因為覺得自己照像呈現出來的臉型總是肥肥圓圓,所以求助米蘭時尚診所的何玲嬅醫師
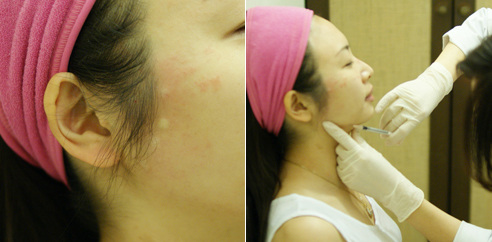
何玲嬅醫師分析小柔拍照臉型不佳的問題:
- 因為下巴在這臉型相對較後縮也較短,讓側麵線條不夠細緻,臉型也會較圓潤。
- 小柔鼻型算不錯的,若鼻子山根也能高挺些將有助於讓臉型更加立體。
- 臉頰肌膚較為鬆弛,讓側麵線條較鈍且不銳利。
何玲嬅醫師對小柔的治療計畫:
何醫師先利用肉毒桿菌素Botox(保妥適)淺層注射技術來進面側臉線條的拉提,何醫師表示因為小柔臉型較為豐滿,不建議再用 RADIESSE :瑞得喜(市場俗稱:晶亮瓷/微晶瓷) 來拉提,而選擇肉毒桿菌素Botox(保妥適)。
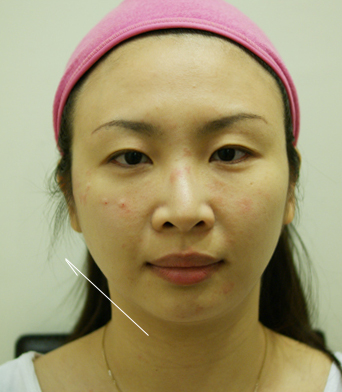

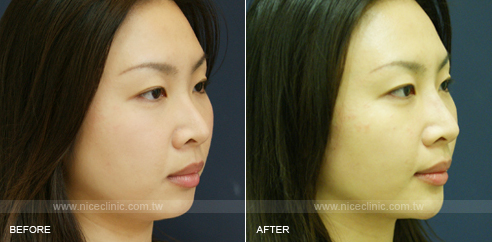
微整型調整後的小柔臉型術前術後比一比


BOTOX (肉毒桿菌):保妥適|衛署醫器輸字第000525號
中文品名:愛力根
保妥適乾粉注射劑|英文品名:ALLERGAN
BOTOX (Botulinum Toxin Type A) Purified Neurotoxin Complex
本藥限由醫師使用 點此可下載完整仿單
適應症:
眼瞼痙攣、半面痙攣、局部肌肉痙攣、斜視、痙攣性斜頸、小兒腦性麻痺引起之肌肉痙攣、上臉部皺紋(皺眉紋、抬頭紋、魚尾紋)、原發性腋窩多汗症、成人中風後之手臂痙攣。因脊髓病變所引起的逼尿肌過動而導致尿失禁之成人病人,且經抗膽鹼類藥物治療無效或無法耐受者。治療有尿失禁、尿急與頻尿等膀胱過動症的成人病人,經抗膽鹼類藥物治療反應不佳或無法耐受必須停藥,且如有需要時,願意及能夠於治療後進行乾淨間歇性導尿(Clean intermittent catheterization) 者。BOTOX 適用於慢性偏頭痛(至少有3 個月時間,每個月≥ 15天,每次持續4 小時以上,且其中至少有一半的頭痛是偏頭痛)成人病人的頭痛預防性治療。(重要限制:BOTOX 對陣發性頭痛(每月頭痛天數≦14天)之安全性及有效性尚無證據證明)。治療成人病人之下肢痙攣,以減少踝關節和腳趾屈肌群(腓腸肌、比目魚肌、脛後肌、屈拇長肌和屈趾長肌)張力增加的嚴重程度。
說明:
- BOTOX (A 型肉毒桿菌毒素)純化神經毒素複合體適用於12歲或12歲以上病人,因肌張力不足造成的斜視和眼瞼痙攣,包括良性眼瞼痙攣或第七對腦神經障礙。
- BOTOX 適用於減少痙攣性斜頸( 頸肌張力不足) 的主觀症狀以及客觀徵候。
- BOTOX 適用於2歲或2歲以上病人,治療因幼年型腦性麻痺的痙攣造成的動態性馬蹄形足畸形。
- BOTOX 適用於治療原發性腋窩多汗症。
- BOTOX 適用於暫時性改善成人上臉部因皺眉紋、魚尾紋、抬頭紋所造成的動態性皺紋外觀。
- BOTOX 適用於治療成人病人之下肢痙攣,以減少踝關節和腳趾屈肌群( 腓腸肌、比目魚肌、脛後肌、屈拇長肌和屈趾長肌) 肌張力增加的嚴重程度。
- BOTOX 適用於治療成人因中風所引起的上肢肌肉痙攣。
- 「斜視」限由眼科專科醫師使用。
- BOTOX 是用以治療因脊髓病變所引起的逼尿肌過動而導致尿失禁之成人病人,且經抗膽鹼類藥物治療無效或無法耐受者。
- 治療有尿失禁、尿急與頻尿等膀胱過動症的成人病人,經抗膽鹼類藥物治療反應不佳或無法耐受必須停藥,且如有需要時,願意及 能夠於治療後進行乾淨間歇性導尿(Clean intermittent catheterization) 者。本適應症之第三期樞紐試驗結果並未直接顯示本藥品療效優於抗膽鹼類藥物,亦未探索本藥品與抗膽鹼類藥物併用之療效安全性。
藥動學方面:
在人體進行藥動學研究並不適用於BOTOX 。使用大鼠進行藥物分布研究指出125I-A 型肉毒桿菌毒素複合體注射腓腸肌後,肌肉擴散緩慢,接著全身性代謝以及尿液排泄快速;肌肉的放射性標記物質含量降低的半衰期約為10小時;於注射部位放射性標記物與大型蛋白質結合,而於血漿放射性標記物大部分結合於小分子,顯示該物質之全身性代謝迅速;給藥的24小時以內,60%的放射性物質排泄於尿液中。肌肉注射125I-A 型肉毒桿菌神經毒素複合體至兔上眼瞼近端內側,進行自動放射性攝影結果也顯示於肌肉的擴散緩慢。
使用離體大鼠神經突觸體片段進行試管試驗指出肉毒桿菌毒素對膽鹼激性末梢有高度親和力,於膽鹼激性末梢,毒素結合至突觸前膜;儘管毒性對神經末梢有高度親和力,但有間接證據顯示,經過放射性標記的毒素,係以逆行性方式向上運送至脊索,當注射高劑量加放射性標記的毒素至貓腓腸肌時,後來於脊索偵測到放射性物質的組織學證據,且位於注射部位同側;未知放射性物質是否仍然與肉毒桿菌毒素結合,但資料顯示,毒素由注射部位經由神經突觸前吸收,以及逆行性沿軸索的輸送等作用。
藥理機轉
2.1治療類別:神經肌肉阻斷劑。
BOTOX (A 型肉毒桿菌毒素)純化神經毒素複合體係經由與運動神經末梢的接受器位置結合,進入神經末梢,以抑制乙醯膽鹼(acetylcholine)的釋放,而阻斷神經肌肉的傳導;當BOTOX 以治療劑量作肌肉注射時,BOTOX 以化學方式使該肌肉產生局部去神經化作用,結果導致局部肌肉麻痺;當肌肉受到以化學方式去神經化時,肌肉萎縮,而可能發展出神經接合器以外的乙醯膽鹼接受器,如此可證明神經確可經由出芽(sprout),而重新對肌肉達到以神經支配其動作,此缺點為具可逆性。
2.2斜視
BOTOX 用於治療斜視時,推定投予BOTOX 經由誘發被注射肌肉萎縮而延長,相對地減低該肌肉拮抗肌的收縮而影響成對肌肉。
2.3眼瞼痙攣
注射BOTOX 對肌肉造成麻痺效應可用於減少眼瞼痙攣引起的肌肉過度異常收縮,一般來說眼瞼痙攣病人接受治療後病情改善平均約需12.5週,才需要再度接受治療。
2.4痙攣性斜頸(頸肌張力不足)
當BOTOX 注射於頸部肌肉時,BOTOX 係由痙攣性斜頸(頸肌張力不足)的客觀徵象以及主觀症狀,兩方面來提供病情的緩解,改良效果包括減少疼痛/ 不適、減少頭部的旋轉、減少肩膀的抬高、減低肥厚肌肉的尺寸及強度,以及對功能性失能病況的改善;基於早期用於未曾接受治療的病人的文獻報告結果,頸肌張力不足病人初期接受BOTOX 治療後,有40%至 58%的症狀顯著改善。
2.5痙攣(幼年型腦性麻痺所致)
BOTOX 注射於腓腸肌產生腳踝位置的改善(馬蹄形足的減少)以及隨後因腳跟接觸地板的增加,而獲得步態的改善。
2.6原發性腋窩多汗症
BOTOX 用於多汗症之作用機轉係經由局部阻斷自主神經系統交感神經膽鹼激性神經纖維支配的汗腺,而抑制膽鹼激性驅使過量排汗;此種效果係經由將肉毒桿菌毒素施打在位於皮膚真皮的汗腺附近而達成此項目的,因此用於此種適應症的注射乃皮內注射。多汗症之典型治療方式係於患部區域,以網格狀圖案作多重皮內注射進行治療。治療目標係將排汗減少至病人可忍受的生理正常程度,完全無汗並非治療目標。
2.7皺眉紋
BOTOX 用於多汗症之作用機轉係經由局部阻斷自主神經系統交BOTOX 注射於皺眉肌及/ 或鼻眉肌時BOTOX減弱下方肌肉過度活化的收縮,減輕皺眉紋的嚴重程度,因而改善面貌外觀。
2.8魚尾紋
魚尾紋是指靠近太陽穴的眼角所生出的傾斜皺紋,明顯、深陷、呈輻射狀,是眼輪匝肌側邊纖維收縮直接導致的結果。注射BOTOX 可改善該部位嚴重皺紋問題。
2.9抬頭紋
水平抬頭紋與額肌長期的動作有關。據受過訓練的觀察人員指出,注射BOTOX 改善嚴重水平抬頭紋的情況可維持高達24週。
2.10成人中風後之手臂痙攣
BOTOX 對於病情的改善部分包括:減低肌肉張力,肌肉活動範圍增加,且用於某些病人,BOTOX 可減少因痙攣狀態導致病人的病廢、失能等。
2.11膀胱失調(膀胱過動症以及因脊髓病變引發的逼尿肌過動)
膀胱注射後,BOTOX 會抑制乙醯膽鹼的釋放,進而影響到逼尿肌作用的中樞傳出路徑(efferent pathways of detrusor activity)。
禁忌症:
本品禁止用於已知對配方中的任何成份過敏者。BOTOX 禁止用於重症肌無力或Eaton Lambert症候群病人。BOTOX 禁止用於建議注射部位有感染現象存在時。對於罹患尿道感染的病人,以及未定期進行乾淨間歇性導尿(CIC)的急性尿滯留及排尿後餘尿量超過200mL的病人而言,不應投與BOTOX 。
警語與注意事項:
6.1 一般注意事項
未曾有任何因意外注射BOTOX 或經口攝食BOTOX 導致全身性毒性案例報告,但若發生意外注射或經口攝食,則病人應在診所內或以門診方式接受醫療監督,經數日至可長達6 週觀察是否有全身性虛弱或肌肉麻痺徵候及徵狀;每小瓶的總含量低於體重6公斤或以上病人,發生全身性毒性的預估劑量。
有周邊神經病變的病例報告,體重126公斤的成年男性經過11週的肌肉注射累積總劑量達1800 U,此種用量明顯超出核准
劑量。臨床上使用曾有若干案例是因本品全身性吸收,以致產生一般性無力和肌肉疼痛的全身性反應。
就理論上而言肉毒桿菌毒素的效果,會因aminoglycoside、spectinomycin 或任何其他可能干擾神經肌肉傳遞的藥物
(例如筒箭毒鹼型肌肉鬆弛劑)而增強;當BOTOX 配合aminoglycosides(例如:streptomycin、tobramycin、neomycin、gentamycin、netilmycin、kanamycin、amikacin)、spectinomycin、多黏桿菌素(polymyxins)、四環黴素類(tetracyclines)、lincomycin 或任何其他可能干擾神經肌肉傳遞的藥物使用時應審慎。
由於BOTOX 用於肌肉萎縮性脊側索硬化或其他可能造成神經肌肉接合的乙醯膽鹼排空病症的病人的臨床安全性經驗仍不足,
故不建議BOTOX 用於治療此類病人。
如同任何其他讓原先坐輪椅病人恢復至可活動的治療一樣,注射BOTOX 後病人應小心逐漸地恢復活動。
BOTOX 的使用安全性及有效性係以產品的適當儲存、正確劑量的選擇以及妥善的調製與投藥技術有關;醫師投與BOTOX須熟諳患部區域的相關解剖學,以及任何由於早先動手術而造成的解剖變化。對標準肌電圖技術的了解,有助於半面痙攣、痙攣性斜頸(頸肌張力不足)的治療,且可用於幼年型腦性麻痺病人,因痙攣造成的動態馬蹄形足畸形。
如同所有其他生物製劑,應準備腎上腺素以及其他若發生過敏性休克時應有的預防措施。
提議注射部位並存有發炎現象或目標肌肉太過虛弱時,使用BOTOX 應審慎。
本品含有白蛋白,白蛋白是人類血液衍生物基於有效供血者的篩檢程序以及產品製造過程,極罕有傳染病毒疾病的風險,傳染庫賈氏病(Creutzfeldt-Jakob disease,CJD)的風險理論值也極低,未曾發現任何因白蛋白造成的病毒性疾病或CJD 病例。
曾發生嚴重或急性過敏反應, 如全身過敏性反應或血清病, 及其他過敏反應, 如蕁麻疹、軟組織水腫和呼吸困難。有些過敏反應發生在單獨使用BOTOX 或與其他藥物併用。若出現此些過敏反應,需停止注射BOTOX 且尋求醫療治療。有一例注射BOTOX 後發生全身性過敏反應死亡的案例,其為不當利用5ml濃度1%的 lidocaine 稀釋注射。BOTOX 和 lidocaine 兩者間的因果關係尚未確立。
BOTOX 不建議用在肌萎縮性脊髓側索硬化症(amyotrophic lateral sclerosis)或其他在神經肌肉連結處消耗乙醯膽鹼產生的異常,因臨床安全性經驗還不足。
6.2心血管系統
曾有使用BOTOX 後產生心血管系統的不良反應,包括
心律不整及心肌梗塞,曾有死亡案例。這些案例中有些原有心血管病史,和BOTOX 的確切關連仍未知。
6.3癲癇
曾有使用BOTOX 後發生全身性癲癇或自發性癲癇的案例,大多發生在先前發生過癲癇的病人。癲癇和BOTOX 的確切關連仍未知。發生在小孩的案例為治療腦性麻痺的痙攣所致。
6.4免疫原性
具有中和力形成的抗體,以A 型肉毒毒素可通過滅活毒素的生物活性降低BOTOX 治療的有效性。具有中和力抗體的形成因素還未知。降低抗體形成可利用在最長注射間隔間給予最低有效劑量。接受BOTOX 治療個體的反應減弱或沒有反應,有數種可能的解釋,包括肉毒桿菌毒素的中和抗體,以及選用的劑量不足、選用注射的肌肉不適當、該肌肉無法用於注射、潛藏的結構異常,例如:肌肉收縮或骨病、相關肌肉形式改變、病人與初期結果做比較的感覺、以及儲存或調製的不當。中和抗體定義為可去活化毒素生物活性的抗體,通常對肉毒桿菌毒素無反應,且具有可驗證的中和抗體濃度的病人比例低於5%;但在長期幼年型腦性麻痺研究中,117位接受BOTOX 治療的病人於27或 39個月偵測得抗體比例為33/117(28%);33個病人中,31人先前有反應;19人繼續有反應,7 人變成臨床無反應,有5 人無法取得進一步資料。
產生中和抗體的關鍵因素是投藥頻率及投藥劑量,當BOTOX 用於治療眼瞼痙攣時若治療比每3 個月一次更頻繁,則觀察到略有耐藥性。為了減低中和抗體的可能,建議注射時間間隔不可比每兩個月注射一次更頻繁,成人在任何兩個月時間之注射劑量不可超過360 U,用於兒童治療馬蹄形足畸形任二個月時間的BOTOX 總劑量不可
超過4 U/kg。
當病人對BOTOX 無反應時,建議採行的方式有:(1)等候至一般治療時間結束;(2)考慮前述無反應的理由;(3)檢驗病人血清是否存在有中和抗體。必須有超過一次療程無效才可將病人歸類為無反應者,原因在於有些病人儘管存在有中和抗體,但仍持續對治療有反應。
6.5支氣管炎和上呼吸道感染發生於接受痙攣治療之病人
接受治療的下肢痙攣成人病人,在使用BOTOX 注射後,發生通報為不良事件之上呼道感染的頻率(總注射劑量300至400單位時,發生率為2%)高於安慰劑組(1%)。
6.6肉毒桿菌毒素類產品之間之不可替換性
BOTOX 的強度使用單位係使用特定檢測方法與製備而得的數值。不可與其他廠牌的肉毒桿菌毒素製劑的強度單位替換使用。因此,BOTOX的生物活性單位無法與其他廠牌的肉毒桿菌(或是其他毒素使用不同檢定方法)相比較或是換算(請參閱性狀段)。
6.7毒素的擴散作用
由BOTOX 及其他已核准之肉毒桿菌產品之上市後安全資料顯示,於某些案例觀察出肉毒桿菌毒素作用會擴散出原先施打的局部範圍。注射後幾小時至數週所發生的症狀與肉毒桿菌毒素的作
用機轉一致,包括肌肉無力,眼瞼下垂,複視,視力模糊,面部無力,吞嚥和語言障礙,便秘,吸入性肺炎,呼吸困難和呼吸抑制及/
或呼吸衰竭。尤其在兒童接受痙攣的治療時,這些症狀可能會造成極大的風險;但這些症狀也可能發生在某些特定狀況的病人,使他們出現以下症狀,包括接受痙攣治療的成人或是其他情況,以及接受高劑量治療的病人:吞嚥和呼吸困難以致危及生命,並曾有死亡的案例,雖然迄今這些狀況與本品的因果關係仍尚未確立。並沒有確切的嚴重不良反應的報告指出,毒素的遠端擴散現象與 BOTOX 於皮下注射時,使用標記劑量20單位(皺眉紋)或是100單位(原發性腋窩多汗症)時有關連性。並沒有確切的嚴重不良反應的報告指出,毒素的遠端擴散現象與BOTOX 於治療眼瞼痙攣的建議劑量(30 單位以下)、治療斜視的標記劑量有關連性。不可超過本品的建議投藥劑量及投藥頻率。
6.8斜視
投與BOTOX 治療斜視期間由於針頭刺穿眼窩,可能發生眼球後方出血,導致足夠危害視網膜的血循環,建議應使用適當的儀器
讓眼窩減壓,也曾發生眼球被針頭刺穿,應準備眼科檢視鏡來診斷此種情況。BOTOX 用於慢性麻痺型斜視無效,只能夠合併手術修補來減少拮抗肌的收縮;BOTOX 用於偏差超過50稜鏡屈光度、限制性斜視、帶有外直肌虛弱的Duane’s 症候群以及手術前拮抗肌過度衰退引發的繼發型斜視的效果仍有疑問,為了使效果顯著需採多次注射。在一個或多個眼外肌麻痺引起可能產生空間迷向(spatial disorientation),複視,或過指試驗(past-pointing)。覆蓋患眼可緩解這些症狀。
6.9眼瞼痙攣
眼輪匝肌注射BOTOX 造成眨眼次數減少,可能導致角膜的暴露、持久性上皮缺陷和角膜潰瘍,特別是用於第七對腦神經障礙病人。由於此種影響,有一眼球無水晶體病例,曾因角膜穿孔而需做角膜移植。先前曾經動過手術的眼睛應小心檢驗角膜感覺,避免注射於下眼瞼區以防止眼瞼外翻,以及積極治療任何因上皮缺水,可能需要防護性眼藥水、軟膏劑、治療性軟式隱形眼鏡、或用貼片或其他手段,將眼睛閉合。由於肉毒桿菌毒素具有抗膽鹼激性活性,故當治療有角隅封閉性青光眼病人,包括解剖上有窄眼角病人,皆應審慎,於眼眶周圍注射肉毒桿菌毒素後,極罕見報告有急性角隅封閉性青光眼發生之報告。
6.10痙攣性斜頸(頸肌張力不足)
頸肌張力不足病人使用A型肉毒桿菌毒素,最常見的嚴重副作用是吞噬困難,偶爾有發生呼吸困難的報告;曾有罕見病例出現吞噬困難,嚴重到需要插鼻胃管進食。注射後吞噬困難可能持續2至3,但注射後持續五個月的報告不常見。曾經至少有二起病例於吞噬困難後,病人因發生吸入性肺炎而致命。將注射胸鎖乳突肌的劑量降低至100 U 可減低吞噬困難的發生率,頸肌質塊較小病人或需要兩側注射胸鎖乳突肌病人,有吞噬困難風險較高之報告,吞噬困難的原因是注射BOTOX後毒素在注射部位附近滲透開來,因BOTOX 的藥理作用分佈所造成。
6.11痙攣(因幼年型腦性麻痺所致)
雖然未曾有研究BOTOX 於腳踝固定收縮病人,但BOTOX 應不可能有效地減少此種病人的馬蹄形足位置。曾有極少使用肉毒桿菌後的嚴重腦性麻痺幼童,伴隨吸入性肺炎致死的案例。需特別注意使用在神經性無力、吞嚥困難或曾有吸入性肺炎或肺部疾病的幼童。
6.12原發性腋窩多汗症
應評估病人的繼發性多汗症的可能起因( 例如甲狀腺機能亢進、嗜鉻細胞瘤),以防止症狀性治療多汗症,而未能診斷出和(或)治療潛在疾病。
6.13成人中風後之局部痙攣
BOTOX 用於治療局部痙攣方面,只曾對一般性醫療照護計畫標準做研究;BOTOX 無法有效用於已知定型攣縮的患部關節,改善關節的活動範圍。使用於中風後痙攣的成年病人需更加小心,避免增加跌倒的危險。若肌肉張力下降無法達到改善生活機能(如:改善步態)、改善症狀(如:減緩疼痛)的預期效果,或是有利於照護,則不應使用BOTOX 去治療成人病人中風後的局部下肢痙孿。
應小心使用BOTOX 在中風老年病人嚴重的下肢痙攣,僅在治療效益大於危險時使用。
6.14脊髓病變引發逼尿肌過動的病人接受治療而引起自主神
經反射失調及尿液滯留症治療脊髓病變引發逼尿肌過動的逼尿肌BOTOX 注射可能引起自主神經反射失調,也可能需要及時治療。臨床試驗中,接受BOTOX 200單位治療的病人其自主神經反射失調發生率較安慰劑治療高(分別為1.5%及 0.4%)。
7不良反應:
通常不良反應係出現在BOTOX 注射後的第一週,且為暫時性;如同任何肌肉注射般,BOTOX 肌肉注射會引起局部疼痛、發炎、異常感覺、感覺遲頓、腫脹/ 水腫壓痛、紅斑、局部感染、出血和(或)瘀青等。注射肉毒桿菌後也曾發現發燒和感冒症狀。針頭注射後的疼痛和/ 或焦慮也曾發生血管迷走神經性反應,包括短暫症狀性低血壓或暈厥。局部虛弱現象乃肉毒桿菌毒素的預期藥理作用。然而,也曾發現鄰近注射部位肌肉及/ 或離較遠的肌肉有虛弱現象。
自從本品上市以來罕有下列不良反應的報告: 皮膚疹( 包括多形性紅斑及乾癬形發疹)、搔 癢。極少發生嚴重或急性過敏反應, 如全身過敏性反應或血清病, 及其他過敏反應, 如蕁麻疹、軟組織水腫和呼吸困難。有些過敏反應發生在單獨使用BOTOX 或與其他藥物併用。
若出現此些過敏反應,需停止注射BOTOX 且尋求醫療治療。有一例注射BOTOX 後發生全身性過敏反應死亡的案例,其為不當利用5ml 濃度1%的 lidocaine 稀釋注射。BOTOX 和 lidocaine 兩者間的因果關係尚未確立。
罕見有自發性死亡報告,偶爾係於使用A型肉毒桿菌毒素治療後因吞噬困難、肺炎和(或)其他明顯衰弱、或過敏反應所造成。曾有涉及心血管系統的不良反應報告,心血管系統的不良反應包括心律不整及心肌梗塞,偶爾有造成致命後果,而有些病人本來就帶有風險因子包括心血管疾病。曾有使用BOTOX 後發生全身性癲癇或自發性癲癇的案例,大多發生在先前發生過癲癇的病人。BOTOX 眼周注射後曾通報出現眼瞼水腫反應。下列不良反應或其他藥物相關不良反應是不分適應症,可能也列於警語與注意事項段落和不良反應段落:去神經性肌肉萎縮症、呼吸抑制和/ 或呼吸衰竭、呼吸困難、吸入性肺炎、發音困難、發聲困難、口乾、斜視、週圍神經疾病、腹痛、腹瀉、反胃噁心、嘔吐、發熱、厭食、複視、視力障礙、聽力減退、耳嗚、暈眩症、顏面麻痺、顏面神經癱瘓、上臂神經叢病變、神經根病變、昏厥、感覺遲頓、感覺不適、肌肉痛、重肌無力症、紅疹、多形性紅斑、搔癢、牛皮癬皮膚炎、多汗症、圓禿包括睫毛脫落、乾眼和局部肌肉抽搐/非自主肌收縮。
不良反應:
通常不良反應係出現在BOTOX 注射後的第一週,且為暫時性;如同任何肌肉注射般,BOTOX 肌肉注射會引起局部疼痛、發炎、異常感覺、感覺遲頓、腫脹 / 水腫壓痛、紅斑、局部感染、出血和 ( 或 )瘀青等。局部虛弱現象乃肉毒桿菌毒素的預期藥理作用。自從本品上市以來罕有下列不良反應的報告:皮膚疹 ( 包括多形性紅斑及乾癬形發疹 )、搔癢或急性過敏反應。 罕見有自發性死亡報告,偶爾係於使用A型肉毒桿菌毒素治療後因吞噬困難、肺炎和 ( 或 )其他明顯衰弱、或過敏反應所造成。 曾有涉及心血管系統的不良反應報告,心血管系統的不良反應包括心律不整及心肌梗塞,偶爾有造成致命後果,而有些病人本來就帶有風險因子包括心血管疾病。
RADIESSE :瑞得喜(市場俗稱:晶亮瓷/微晶瓷)|衛署醫器輸字第019007號
中文品名:瑞得喜植入劑|英文品名:RADIESSE Injectable Implant
Radiesse 植入劑為中度至重度臉部皺紋和皺摺矯正的皮下植入劑,如鼻唇溝,要修復和/或矯正由於人類免疫缺乏病毒而有臉部脂肪萎縮(lipoatrophy)現象的病人
產品規格:
0.8cc以及1.5cc
產品說明:
RADIESSE (瑞得喜)植入劑是一種滅菌,無熱原因子,半固體,黏稠狀的植入劑,它的主要成分是人工合成CalciumHydroxylapatite(CaHA,氫氧磷灰石鈣)懸浮於滅菌注射用水,甘油和SodiumCarboxymethyIcellulose甲基纖維素鈉)的凝膠載體中。RADIESSE (瑞得喜)植入劑(1.5cc和08cc)含有CaHA的粒大小範圍在25-45微米。RADIESSE植入劑應使用25-27號針頭射。
主要用途/適應症:
RADIESSE (瑞得喜)植入劑為矯正中度至重度臉部紋和皺(如鼻唇溝)的皮下植入劑,RADIESSE (瑞得喜)植入劑亦可用於修復和/或矯正由於人類免疫缺乏病毒而產生臉部脂肪萎縮(lipoatrophy現象的病人。
使用禁忌:
- RADIESSE (瑞得喜)植入劑禁止使用在有過敏性病史而有嚴重的過敏顯示的病人,或者有多種嚴重的過敏性存在或病史。
- RADIESSE (瑞得喜)植入劑不可使用在對任何成分會產生過敏的病人。
- 患有出血疾病者禁用RADIESSE (瑞得喜)。
警告事項:
- RADIESSE (瑞得喜)進入血管中可能導致血管栓塞、血管堵塞、局部缺血或梗塞·注射軟組織填充劑時要特別小心,例如緩慢注射RADIESSE (瑞得喜),並施加必要的最少壓力。已有報告於部注射組織填充物到血管內導致相關的儿但嚴重的不良反應事件,包括暫時性或永久性的視力障礙失明、腦缺血或腦出血,導致中風·皮膚壞死和其下的臉部結構損害。若病人出現任何以下症狀,立即停止注射,包括视力變化、中風徵兆、皮膚發白、或手術過程中或手術短時間後不專常的疼痛。若發生血管內注射,病人應即時接受醫療照護,並可能由適當的醫護人員專家進行評估。
- 病人在其治療部位或附近皮膚有發炎或感染时應延緩RADIESSE (瑞得喜)植入劑的注射直到發炎或感染的過程得到控制。
- 目前已知病人對注射過程產生的反應主要包括短期(也就是<7天)的瘀傷,發紅和腫脹。欲明瞭細節請參考本說明書中「不良反應」章節。
- 應特別小心避免注射進入血管輸入脈管系統內可能造成血管堵塞或引起梗塞或栓塞,從而導致局部缺血、壞死或損傷。已有發生在唇部、鼻子、眉間或眼部的通報案例使用其他注射劑時所發生的併發症顯示,用力注射進入眉間和鼻子的淺層皮膚血管可能導致逆行進入視網膜動脈,從而造成血管阻塞。
- 避免過度矯正(過度填充)病人的輪廓。RADIESSE (瑞得喜)植入劑的治療效果會讓病人的皺紋或折在幾週內逐漸改善(詳情請見「病人治療」)。
- 本產品用於唇部的安全性和有效性尚未確定。目前已有關於伴隨使用RADIESSE (瑞得喜)植入劑注射部產生小結節的報告被發表。
- 以下110-11-08更新
- 避免過度矯正(過度填充)病人的輪廓·RADIESSE (瑞得喜)植入劑的治療效果會讓病人的皺紋或皺折在幾遇內逐漸改善。詳情請參閱「治療的特殊性」章節。
- 請特別注意不要將植入劑注射人手部靜脉或肌腱注射入机腱會使肌腱弱化進面造成肌腱斷裂注射人靜脈則會引起栓塞或血栓。
- 注射入手部造成的不良反應可能持續14天上。詳情請參考「不良反應」章節。
- 注射入手背可能造成暫時性的手部活動困難(有48%的研究病人出現此不良反應)。Fitzpatrick皮膚類型為第 IV-VI的病人出現手部功能性活動困難的風險更高(Fitzpatrick皮膚類型為第IV-VI類的病人中有68%出現此不良應)。
- RADIESSE (瑞得喜)植入劑可能造成手背的結節或腫塊(有12%的病人出現此不良反應),而此現象可能持續1年。
- 未曾對脂肪組織嚴重流失且靜脈和肌腱明顯可見的病人進行植入研究。本產品用於此類病人的安全性和有效性尚未確定。
- 未曾對單個手背植人RADIESSE (瑞得喜)植入劑超過3cc的療程研究。已知提高注射量可能使瘀青風險增加。對單個手背進行再度植人RADIESSE (瑞得喜)植入劑超過1.6cc的療程,可能造成較多的不良反應(如潑紅、疼痛、腫脹與能性活動困難)。
注意:
注意:使用前請務必詳閱原廠之使用說明書並遵照指示使用。注意:台灣醫藥相關法規的規定限制本項醫療器材僅供持有軌照的醫師售賣或使用。
注意事頊:
- 為了將潛在併發症的凤險降至最低,RADIESSE (瑞得喜)只能由具有適當訓練、經驗以及對注射部位及周圍有解剖學知識的醫護人員使用。
- 為了將潛在併發症的風險降至最低,醫護人員應充分熟習本產品、產品教材以及完整仿單。
- RADIESSE (瑞得喜)植入劑的Calcium Hydroxylapatite(CaHA)顆粒是不容輻射線透過的,因此在電腦斷層掃描(CT Scan)清楚可見,而在標準或一般的X射線攝影下則有可能可見。在58位病人的X射線攝影研究中並未顯示RADIESSE (瑞得喜)植入劑可能掩飾不正常的組織,或在電腦斷層掃描(CT Scn被判斷為腫瘤病人應被告知RADIESSE (瑞得喜)植入劑不容輻射線透過的特性,如此病人才能夠告知他們的醫護照顧人員以及放射線診斷醫師。
- 建議醫護人員在治療前與病人討論軟組織注射的所有潛在凤險,並確保病人瞭解潛在併發症的徵兆及症狀。
- 用於患有人類免疫缺乏病毒的病人時應由具有矯正此類患者面部容積流失專門技術的醫護顧人員在詳讀產品、產品教育資料以及完整的醫師使用說明書後方可注射。
- 產品包裝僅供單一病人使用不可再滅菌。如發現包裝被打開或破壞則不可使用。如:發現注射針筒的尾端帽套或注射針筒的推捍不在正確位置上不可使用。
- RADIESSE (瑞得喜)植入劑超過三年的長期安全性和有效性在臨床試验中尚未研究。
- RADIESSE (瑞得喜)植入劑用於有痛(keloid)形成和肥厚性疤痕體質的病人上之安全性尚未研究。
- 如同所有經皮手術,RADIESSE (瑞得喜)植入劑注射可能帶來感染的危险。使用時應遵循有關注射式植入材料的標準注意事項。
- RADIESSE (瑞得喜)植入劑使用在懷孕期間、哺乳中的女性或18歲以下的病人的安全性尚未確定。
- 使用抗凝血劑類药物(如阿斯匹靈或warfarin)的病人接受任何注射時,其接受注射的部位可能產生較嚴重的瘀傷或出血。
- 當有可能觸到病人體液時應遵守標準注意事項。注射中必須以無菌技術處理。
- 注射完成後,注射針筒和針頭有潛在性的生物危險。使用過的針筒及針頭的管理和處理應遵循標準的安全作業程序以及符合地方政府、州政府和聯邦政府的規定。
- 病人應被告知在治療後約4小時內或直到任何腫或發紅消前需減少暴露在大量陽光下或暴露在高熱下。
- 應用於眶骨膜部位的安全性和有效性尚未確定。
- RADIESSE (瑞得喜)植入劑與其他物或其他植入劑的交互作用尚未有研究。
- RADIESSE (瑞得喜)植入劑合併皮膚治療(例如脫毛、紫外線照射或雷射、機械或化學換膚手術)的安全性尚未在對照臨床試驗中得到評估。
- 如在使用RADIESSE (瑞得喜)植入劑處理後根據皮膚反應考虑雷射治療、化學换膚或任何其他手術,有可能在植入部位誘發炎症反應。如果採用此類手術後,在皮膚完全疮合之前使用RADIESSE (瑞得喜)植入劑,同様可能在植入部位誘發炎症反應。
- 為避免針頭損壞,請勿當試拉直曲的針頭將其丟,並用備用針頭完成手術。
- 請勿給用過的針頭加蓋。用手去加蓋是一種危險的做法,應避免。
- 對發生過皰疹的病人注入RADIESSE (瑞得喜)可能重新引發疹。
不良反應:
請參閱衛生福利部食品藥物管理署:RADIESSE (瑞得喜)仿單連結
適應症 :

使用禁忌 :

警告事項:

RADIESSE 瑞得喜(晶亮瓷/微晶瓷) Q&A 常見問題
Ⓠ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)經過幾次治療才會有效?
Ⓐ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)只要一次注射就可以看到明顯的效果,若有不滿意或需要填補,可和治療醫師充分溝通,依醫師指示進行複診,以評估是否需要再進一步治療,以達到預期的成效。
Ⓠ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)是否有產生副作用?
Ⓐ:一般針劑的注射治療相同,注射部位會有輕微的腫脹、疼痛,少數病患有發癢、泛白等症狀,但於幾天內就完全恢復。
Ⓠ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)注射在皮膚組織經過一段時間後會有鈣化(硬化)的情況嗎?
Ⓐ:不會,RADIESSE 瑞得喜(晶亮瓷/微晶瓷)晶球隨著時間會逐漸被人體吸收,留下來的是富有柔軟彈性的新生膠原蛋白。
Ⓠ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)適合施打的部位?
Ⓐ:鼻型雕塑、填補山根、下巴雕塑、嘴角紋、法令紋填補、蘋果肌填補、眉骨、夫妻宮填補、手背塑形(詳情請參考不良反應章節)。
Ⓠ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)術前的注意事項?
Ⓐ:
- 術前注意事項:當天不要化妝、喝酒、吃辛辣的食物或使用三溫暖
- 嚴重過敏病史、妊娠者、哺乳者、治療部位發炎或感染者不宜施打
- 治療前告知您醫師,目前正在服用的藥物及有沒有過敏的病史
- 一週內有重要事情則建議延後施打
Ⓠ:RADIESSE 瑞得喜(晶亮瓷/微晶瓷)術後的注意事項?
Ⓐ:
- 施術當天請勿飲酒或使用三溫暖
- 注射後請立即的冰敷或冷敷注射部位,以幫助紅腫及瘀傷的減緩,建議2天內仍需間歇性的冰敷,直到腫脹逐漸消退
- 注射後,因個人體質的不同,有些人會出現暫時性的不適應狀況,
例如:暫時性腫脹、發紅、疼痛、瘀青現象,通常於注射後1~2週會自動減輕症狀- 注射後2天內應輕柔地清洗注射區域,避免用力揉搓和按壓
- 盡量避免碰觸或是按摩注射區域
- 注射後5~7天內可以回診追踨,兩週內可以視情況追加注射
台灣衛生福利部仿單/許可證相關內容
VOLITE 芙潤(長效保濕針) 衛部醫器輸字第032333號
中文品名:愛力根
喬雅登芙潤(含利多卡因)|英文品名:Allergan
Juvederm VOLITE
說明
Juvéderm VOLITE 是無菌、無熱原、非動物來源的交聯型玻尿酸生理液。以凝膠形式預先填充於有刻度、拋棄式注射針筒內。每盒含有兩支 1 mL Juvéderm VOLITE 注射針筒、4 個僅限用於注射Juvéderm VOLITE 的拋棄式 32G1/2”無菌注射針頭,並含一張產品仿單及一組標籤以便追蹤。
適應症
- Juvéderm VOLITE 是一種作為治療用途的注射型凝膠植入物,可填補臉部皮膚表層的凹陷,例如細紋,並可增加真皮含水量。
- Juvéderm VOLITE 必須由專業醫師使用,依當地適用法規,進行皮內注射使用。
- 本品含 Lidocaine 可以減低治療過程中的疼痛。
禁忌症
- 建議每次治療時不要注射超過 4ml 的Juvéderm VOLITE。
- 請勿將Juvéderm VOLITE 注射至眼瞼。
- 請勿注射至血管內(血管內)。注射至血管內可能會造成栓塞、血管阻塞、缺血或梗塞。
- 請勿過度矯正。
- Juvéderm VOLITE 不可用於:
- 尚未接受治療的癲癇病人;
- 容易產生肥厚性疤痕的病患;
- 已知對玻尿酸和/或革蘭氏陽性細菌蛋白質過敏的病患,因為玻尿酸為鏈球菌類細菌所分泌;
- 已知對 Lidocaine 或醯胺類局部麻醉劑過敏的病患;
- 紫質沉著病 (porphyria) 的患者;
- 懷孕或哺餵母乳中的女性;
- 孩童。
- Juvéderm VOLITE 不可用於有皮膚發炎及/或感染(痤瘡、皰疹等)的部位。
- Juvéderm VOLITE 不可與雷射治療、深層化學換膚或磨皮療程同時進行。至於表面換膚,若有明顯發炎反應產生,建議不要注射本產品。
使用注意事項
- Juvéderm VOLITE 僅適用於真皮內的注射。
- 醫師必須將本產品含有利多卡因的事實列入治療時的整體考量。
- Juvéderm VOLITE 不可用於隆乳/乳房重建。
- 一般而言,植入醫療器材都有伴隨發生感染的風險。應遵守注射藥物的標準注意事項。
- 目前並無任何 Juvéderm VOLITE 注射至已使用其他非 ALLERGAN 皮膚填充物治療之部位的臨床資料。
- 建議不要注射在有永久性填充物治療過的部位。
- 目前尚無任何針對 Juvéderm VOLITE 在曾經或目前患有自體免疫疾病、自體免疫缺陷,或正在接受免疫抑制治療病患的療效和耐受性之相關臨床資料。因此,醫師應依據病人個案以及疾病的狀況所需的治療,決定施打劑量與配套治療方式。醫師也應確實監控此類病患,尤其建議應先對這類病患進行初步皮膚過敏測試,若疾病為活躍狀態,則最好避免注射本產品。
- 目前尚無任何關於 Juvéderm VOLITE 使用在有嚴重和/或多種過敏病史病患之藥物耐受性臨床資料。因此,醫師應依據病患過去過敏的情況,依個案決定是否施打,並確實特別監控這些高危險病患。尤其建議在注射前先做皮膚敏感測試或給予適當的預防性治療。若有過敏性休克病史,建議不要注射本產品。
- 有鏈球菌病史(復發性喉嚨痛、急性風濕熱)的病患在進行任何注射前,應先經過皮膚過敏檢驗。若為有心臟併發症的急性風濕熱病患,則建議不要注射本產品。
- 對於正在使用抗凝血作用藥物或使用可能造成出血不止之物質(Warfarin、乙醯柳酸、非類固醇消炎藥或其他已知會延長凝血時間的物質,例如:添加大蒜或銀杏等草藥補充品)的病患,必須被告知注射時血腫或流血的風險會增加。
- 目前並無對於每 60 公斤(130 磅)體重者每年注射 ALLERGAN 皮膚填充物超過 20 mL 的相關安全性資料。
- 由於 Juvéderm VOLITE 含有利多卡因,因此不建議與會降低或 抑制肝臟代謝藥物(cimetidine、beta-blockers 等)合併使用。
- 由於 Juvéderm VOLITE 含有利多卡因,因此對有心臟傳導紊亂 徵候群的患者需小心使用。
- 請建議病人在注射後 12 小時內不要上妝,且在注射後的 2 週內避免長時間暴露在陽光、紫外線或 0°C以下低溫、以及三溫暖或土耳其浴。
- 本產品的成分相容於磁振造影檢查
不良反應
必須向病患告知此療程有關的潛在副作用,且副作用可能立即發生或延遲發生。這些副作用包括但不限於:
- 注射後發炎反應(發紅、水腫、紅斑...)且可能伴隨有發癢和/或壓痛及/或感覺異常。上述反應可能會持續 1 星期。
- 血腫。
- 注射部位出現硬塊或小結節。
- 注射部位有發生膚著色或變色的現象,尤其是玻尿酸填充物注射過於淺層和/或皮膚偏薄部位(廷得耳效應)。
- 療效不佳或填補效果不彰。
- 曾有通報過將皮膚填充物注射至血管內以致栓塞,其中包括暫時或永久性視力障礙、失明、腦缺血或腦出血、導致中風、皮膚壞 死以及下方組織受損之罕見但嚴重的不良事件。病患若出現下列任何症狀,應立即停止注射,包括治療期間或結束後短時間內出現視力變化、中風徵兆、施打區域變白或異常疼痛。若發生注射至血管內的情況,病患應立即就醫,可能的話並由適當的專科醫師進行評估。另外亦曾通報發生玻尿酸和/或含利多卡因注射後出現膿瘍形成、肉芽腫以及立即性或遲發性過敏等案例。因此,請務必將這些可能發生的併發症納入考慮。
- 病患的發炎反應若持續超過一星期、或是任何其他副作用的發生,都必須盡快向其醫師回報。醫師應以適當方法治療。
- 任何與注射 Juvéderm VOLITE 有關的其他不良副作用都必須回報經銷商及/或製造廠。
- 在臨床研究中,最常見的注射部位反應是發紅,其在治療後 2 週內消退。發生注射部位腫脹,其通常在治療後 1 週內消退。
適應症 / 使用禁忌


警告事項

VOLUMA 豐顏 衛部醫器輸字第023257號
中文品名:愛力根
喬雅登豐顏(含利多卡因)|英文品名:Allergan
Juvederm Voluma
說明
Juvederm YOLUMA with lidocaine 是無菌、無熱原、非動物來源的交聯型玻尿酸生理液。以凝膠形式預先填充於單次使用的注射針筒內。
每盒含2支1ml含uvedem OLUMAwith d 注射針,支2G1/2"單次使用針頭以供注射 Juvederm VOLUMA with idoca之用。並含一張產品仿單及一組供醫師/病患用標以便追蹤。
適應症
Juvederm VOLUMA with lidocaine 為注射式植入物,用於回復肌膚凹陷的臉部。本產品含lidocane可以低治療過程中的疼痛。
禁忌症
- 請勿將Juvederm VOLUMA with lidocaine 注射至眼眶周圍區(眼脫、眼袋區、魚尾紋)和眉間區或唇部。
- 請勿注射至血管(血管內)。血管內注射可導致栓塞、血管閉塞、血、組織壞死或梗塞。請勿過度矯正。如果發生過度矯正,會逐漸被再吸收,因為 Juvederm VOLUMA with lidocaine 是非永久性的植入物・然而,醫師可自行決定是否採取適當的步驟以處理此過度矯正的現象。
- Juvederm VOLUMA with lidocaine 不可用於:
- 尚未治療的癲瘸病人。
- 容易產生肥厚性疤痕的病患。
- 已知對玻尿酸和/或對革蘭氏陽性細菌蛋白質過敏的病患(本產品玻尿酸由鏈球菌屬細菌產生)。
- 已知對lidocaine 或含胺類局部麻醉劑過敏的病人。
- 紫質沉著病(porphyria)的患者。
- 懷孕或授乳的女性。
- 孩童。
- Juvederm VOLUMA with lidocaine不可用於有皮膚發英和/或感染過程(痤瘡、疤疹等)。
- Juvederm VOLUMA with lidocaine不可與雷射治療、深層化學換膚或磨皮療程同時進行。至於表面換膚,若有明顯發反應產生,建議不要注射本產品。
- 請依原包裝使用本產品。改變包裝或超過使用方法可能對產品的滅菌,均質和功能有不良影響,所以本產品不再有保證。
警告
- 請確認產品標錢上的保存期限。
- 如果注射器內容物出現分離跡象和/或出現混,請勿使用注射器。
- 不可重覆使用。如果此產品再使用無法保證無菌。
- 不可重覆滅菌。
- 針頭(CE0123 TSK Laboratory,日本):
- 使用過的針頭、針管及注射針必須適當的丟棄。請參考現行適用之相關規定以確認正確的棄置方式。
- 切勿試圖將學曲的針頭扳正,請將其丟棄並更換新的
使用注意事項
- Juvederm VOLUMA with lidocaine 僅使用於皮下的,上骨膜或深層真皮注射其注射的技巧與深度決定於治療部位的差異。
- 醫師必須將本產品含有lidocane的事實列入治療時的整體考量。
- 玻尿酸植入物誤注入血管可能引栓塞、血管阻塞、血或組織死。
- Juvederm VOLUMA with lidocaine 不建議用於肌肉注射。
- Juvederm VOLUMA with lidocaine不適用於隆胸/乳房重建。
- 一般而言,入醫療器材都會伴隨有發生感染的風險。感速循與注射材料相關的標準預防措施。
- 目前並無任何 Juvederm VOLUMA with lidocaine注射至曾使用非 Allergan 填充物治療之部位的臨床資料。
- 不可注射在有永久性植入物治療部位。
- 沒有關於Juvederm VOLUMA with lidocane注射到鼻中線,鼻尖和手術後/創傷性鼻子的有效性和耐受性的臨床款據。由於可用於容納注射產品的空間有限以及由於療痕和/或解剖學破壞導致的手術後/創傷性鼻子,醫師感該意識到鼻尖中血管損害/損傷的風險增加。
- 目前沒有關於Juvederm VOLUMA with lidocame注射在有自身免疫疾病或最近自身免疫缺陷或正在接受免疫抑制治療的患者中的效率和耐受性的臨床数據。醫師感依據疾病的情况與所需的治療,依個案決定是否施打。醫師也應確實控此類病惠,尤其建議應先對這類病 惠進行過反感的初步皮膚测試,若疾病為活躍狀態,則最好避免注射本產品。
- 目前尚無任何關於Juvederm VOLUMA with lidoce 使用在有嚴重和或多種過敏病史或病患禁物耐受性臨床貴料。醫師感依據病患過去過敏的情况,依個案決定是否施打,並確實特別監控這些高危險病惠。尤其建議可在任何注射之前提出用於過敏的皮膚测試或適當的預 防性治療。如果出現過緻性休克史,建議不要注射該產品。
- 有鏈球菌疾病病史(復發性喉痛、急性風濕熱的病患在進行任何注射前,感先經過皮膚過敏的测試。若有心臟供發症的急性風漏热病 惠,則建議不要注射本產品。
- 對於病患正接受抗凝血治療或使用可延長出血時間的物質(抗凝血劑、阿斯匹靈、非類固醇消英禁物、或已知會增加凝血時間的其他物質,如大蒜或跟杏葉等草崇補充劑。)必須被告知在注射時血腫或流血的潛在風險會提高。
- 每一療程,每一治療部位注射量不可超過2ml。
- 目前尚無任何關於每年每60公斤(130磅)體重注射起過20毫升的 Allergan 皮膚充填劑的相關安全性臨床資料。
- 因本產品含利多卡因,Juvederm VOLUMA with lidocn 不建議與會降低或抑制肝臓代謝藥物(cimetidine,beta-blocker 等合併使用。
- 因本產品含利多卡因,對心臟傳導異常者需小心使用.Juvederm VOLUMA with lidocaine.
- 應建議病人在注射後12小时內不要上妝,且在注射後的2週內應避免長時間暴露在陽光、紫外線和溫度低C之下、並避免使用三溫暖或土耳其浴。
- 建議病人在注射後幾天避免在注射區按摩與或施加壓力。
- 本產品的成分相容於磁振造影檢查。
- 玻尿酸植入物禁止於全身麻醉下使用。
不良反應
病患必須被告知此療程有關的在副作用,副作用可能立即發生或延遲發生。這些副作用包括但不限於此:
- 注射後產生發反感(發紅、水腫、紅斑...)可能伴隨有發癢和/或壓痛,以及/或感覺異常。上述反應可能會持續1星期。
- 血腫。
- 注射部位有硬塊或小結節。
- 注射部位有發生皮膚著色或變色的現象。特別是當玻尿酸皮膚填充劑過於表面和/或皮膚薄(Tyndall效應)時。
- 療效不佳或填補/重建效果不彰。
- 根據報告在部和組織壓迫中血管內注射皮膚填充劑的見但嚴重的不良事件包括暫時性或永久性視力障礙、失明、腦缺血或腦出血、導致中風、皮膚壞死和對顏面下層/內部結構的損傷。如果患者出現以下任何症狀,包括視力變化、中風跡象、皮膚變白或手術過程中或手術後不久出現異常疼痛,請立即停止注射.如果發生血管內注射,患者應該得到及時的醫療處理並且可能接受適當的醫事人員進行評估。報告退顯示玻尿酸和/或含利多卡因注射後的膜腫、肉芽腫和立即或遲發的過敏反應。因此,建議將這些潛在風險考慮在內。
- 病患發炎反應維持1星期以上、或是發生任何其他副作用反感,必須回報醫師。醫師應以適當方法治療。
- 任何與注射Juvederm VOLUMA with lidocaine有關的其他不良副作用都必須回報經銷商與/或製造廠。
使用方法一藥量學
- 本產品設計用於注射於深層真皮、皮下或上骨膜經由符合當地合適法規之專業醫師下進行。為了最大限度地降低潛在併發症的風險,並且精確度對成功治療至關重要,因此本產品應由受過注射填充物相關特殊專業訓練的器師進行。充分了解治療部位解剖結構造與生理是必要的
- 在注射之前,壓下針筒推進器直到本產品流出針頭。緩慢注射並施加所需的最小壓力。
- 如果針頭或針管阻塞,切勿對針推進器施壓,應停止注射並更換針頭或針管。未依照這些注意事項可能造成注射針脫離舆/或產品溢漏在uer-lock處/或增加血管損害的風險。
- 在針頭注射前後,建議稍微抽出針筒推進器進行抽吸並確認針頭不是在血管內的。
- 如果在注射期間的任何時候膚色發生立即漂白,則感停止注射並採取適當的措施,例如按摩該區域直至其恢復到正常膚色。
- 矯正的程度和持續時間取決於所治療損的特微,植入部位的組織感力植入物在組織中的深度以及注射技術。注射量取決於根據醫師的經驗要校正的區域。
- 不要過度矯正,因為過量注射可能會引起某些副作用,如組織壞死和水腫。
- 可能需要使用Juvederm VOLUMA with lidocne 進行補充治療(用於實現最佳矯正)和/或重複(用於維持最佳矯正)治療。建議等到兩次注射之間副作用都已解決(最小間隔為2週)。注射後,必須按摩治療部位,以確保注射物已均勻分布。依據“愛力根“喬雅登豐顏“Allergan" Juvederm VOLUMA,衛署醫器輸字第020697號)的床試驗資料頭示,GAIS(Global AsthecImprovement Scale)評估第一次注射後6-18個月治療期間,有99%的受試者(總人數=102 人)可達到“頭著改善”“明顯改善“或"改善”的評量。效果持續的時間取決於病人的差異、環境因子、注射量及醫師使用的注射技術。然而,在第一次治療後,為了達到想要的矯正程度可能需要追加一次注射本產品。重複相同程序直到獲得滿意的結果。追加注射的需求會因病人不同而有差異且必須由經受訓的專業醫師評估。
適應症

禁忌症

Defyne:瑞絲朗-亮采|衛部醫器輸字第029748號
中文品名:瑞絲朗-亮彩(含利多卡因)|英文品名:Restylane Defyne
使用前請務必詳閱原廠之使用說明書並遵照指示使用
組成:
- 玻尿酸(Cross-linked hyaluronic acid):20 mg/ml
- 鹽酸利多卡因(Lidocainehydrochloride):3 mgml
- 生理緩衝液pH7(Physiologicl bufferpH7):含量足以調製1毫升
- 交聯度:7-10%
產品敘述:
Restylane Defyne 為無菌、生物可吸收、非動物來源的交聯玻尿酸且添加3mglm 鹽酸利多卡因的透明凝膠凝膠预填充於一塑膠針筒中,且此針筒經過熱菌。針劑和2支27G/2超薄壁的針頭以泡殼分别包裝針頭經過放射線滅菌,本產品僅限單次使用,為確保後續追蹤,包裝所附之病患紀標應黏貼於病患病歷上。
適應症:
Restylane Defyne 是可用於加强臉部组織的飽滿程度RestylaneDefyne 建議用於矯正重度皺紋、或美化唇形骨,根據將治療的區域與组織支撐力,本產品應該注射於真皮層的中至深層、嘴唇的黏膜下層或皮下組織。配方中添加Lidocine 到產品中用於減少治療注射时所造成的疼痛。
本產品僅限符合當地法規且受過注射技巧訓練的醫生所使用。在初次治療之前,建議聯絡當地Galderma 業務代表以取得培训機會的資訊。
作用機制:
Restylane Defyne 增加組織體積以達到恢復臉部肌膚輪廓到理想的程度。填充和支撐的效果來自於交聯後玻尿酸結合水的能力。
禁忌症:
- 對玻尿酸過敏者或以蘊胺類局部麻醉者
- 紫質症者(先天性新陳代謝異常)
警告:
- 不可注射於靠近急性疾病例如:發炎、感染或腫痛的治療部位。
- 不可以血管内方式注射。其他可注射式的醫療器材,無意注射入或靠近血管可能會導致血管阻塞或收缩,形成局部缺血或壞死。
- 不可注射到出血异赏或正在服用抗凝血藥物的患者。
- 不可注射到已經有非玻尿酸的植入物之區域。
- 勿重覆滅菌。
- 勿與其他產品混合使用。
- 透明質酸與四級銨鹽化合物(例如benzalkoniumchloride)不相容,因此,本產品勿與四級銨鹽接觸或接任何曾經接過四級銨鹽之醫學手術器具。
- 本品多次重複使用後形成亞瑟氏反惠(ArthusReaction)的機率不明。
不良事件:
- 病惠必須被告知關於注射過程及使用本產品的潛在風險和不良事件。
- 下列上市後不良事件已經被記(非詳細清單):血管性水腫、萎縮疤痕、水泡、瘀傷、微血管異常例如微血管擴張、皮膚變色、紅班、過赦、硬化、染、發、血/壞死、結塊、神經症狀例如感覺異常、疼痛/痛、/結節、搔癢、皰疹病毒感染再次活化、短時間作用的如水腫和蕁麻疹。
- 一般注射玻尿酸凝膠和使用本產品可能發生的其他潛在的不良事件已經被記錄於如下:膜腫、痤瘡、產品移位(device dislocation)、管(fistula)、肉芽腫、皮疹和視覺障礙。
- 與注射相關的不良事件例如:瘀傷、紅斑、搔癢、水腫、疼痛/觸痛通常於注射後一周內自動痊癒。
- 無意的血管內注射可能導致血管損傷或植入其他可植入的產品可能導致血管收缩缺血或死可能表現在植入部位或受影響的血管所供應血液的區域,或極少可能因為栓塞而造成其他器官缺血。部美容治療有少數報告顯示,缺血影響眼睛而導致視力喪失,且影響大腦造成顧內阻塞注射鼻子後,可能發生缺血壞死,尤其是先前隆鼻過的病患。
- 有報告顯示植入部位的發英症狀出現於注射後不久或延長至數週。由於不恰當的感染治療可能導致併發症,例如:化膿,所以如發生原因不明的感染,應排除為不良事件,必要時需進行治癒。且不建議口服類固醇而不合併抗生素治療。如發生持續或復發性的發炎症狀,考慮以抽吸/排出、擠壓或酵素降解(使用已被科學文獻所佐證之玻尿酸降解酶)來移除本產品。在執行任何移除程序前,為了方便觸診,可以NSAID治療2-7天或服用皮質類固醇小於7天來減低水腫情形。
- 曾經有醫療上重大不良反應的病惠,重複治療時,需將先前反應的嚴重度列入考量。
- 請聯紫當地Galderma 代表或代理商通報本產品的不良事件。
使用注意事項:
注射式醫療器材一般注意事項:
- 為了避免穿刺或擠壓到血管、神經和其他脆弱的結構,對於治療部位具解剖學上的知識和特別注意是必要的。
- 注射過程可能有感染的風險。無菌技術與標準规範防止交叉感染是必要的。
- 當治療區域由於缺血風險升高而需使用限制性的輔助循環系統時,需特別小心。
- 當治療的臉部區域僅有少量的軟組織支撐或軟組織覆蓋,例如:眼眶周圍,需特別小心以避免明顯的腫塊。
- 黑眼圈(pigmented dark lower eye lid circles)、皮膚薄和容易水腫的病惠不適合注射於下眼眶區域(lower periorbital region)。
- 使用免疫抑制劑的病惠也不適合治療。
- 容易形成增生性疤痕(hypertrophic scars)或其他癒合異常的病患,需特別小心治療。
- 注射過程可能導致潛在或非顯性的皰疹病毒感染再次活化。
- 正在服用阿斯匹靈、非固醇類抗發炎藥(NSAID)等影響血小板功能的患者,可能會因注射而增加該部位的瘀傷或出血。
- 對治療結果存有過度期待的病人不適合使用本產品。
- 如果發現包裝損壞,請勿使用。
- 假如針內容物呈現混濁時,請勿使用。
使用本產品的特別注意事項:
- 本產品不適用注射在骨膜上區域(supraperiosticzone或皮下组織以外的部位。
- 當同時使用利多卡因在牙科麻醉或局部給藥時,所給予的總量必須列入考量。高劑量的利多卡因(超過400mg)願現影響中框神經系統和心臟傳導的急性中毒症狀。
- 由於全身性毒性加成,所以當病惠接受其他局部麻醉劑或蘊胺類相關麻醉劑,例如:某些抗心律不整藥物,需特別小心。
- 使用利多卡因在具有癲痛、心臟傳導受損、肝功能嚴重受損、或嚴重胃功能不全的患者身上需特別小心。
- 假如本產品的注射深度太靠近表皮,這可能導致可見的腫塊和/或呈現淡藍色。
- 在任何局部發炎反應消失前,患者必須避免讓治療部位接觸高溫(日光浴、三溫暖、蒸汽浴等)或極度低溫。
- 若雷射治療、化學换膚或其他使皮膚刺激的程序在本產品的術後執行,有導致在植入部位引起發炎反應的風險這也適用於若施打本產品前,皮膚已施打其他產品並完全意合。
- 在每次療程的每個治療部位,最大建議使用量為2ml,本產品單一療程最大建議總注射劑量為10ml,而實際注射劑量由醫師診斷評估。
- 本產品尚未於懷孕或哺乳中的婦女進行測試。
- 勿使用於孩童。
- 本器材之使用須符合「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」之规定。
效能:
約有50%病患,在第一次治療法令後,需追加一次射本產品。在一個隨機對照多中心研究,本產品用於矯正重度法令紋,在治療48週,有333%維持2個級距的改善·中度法令纹58.9%的患者維持1個級距的改善效果。
許可證仿單證照:

適應症 / 使用禁忌 / 警告事項:

Volyme:瑞絲朗-丰采|衛部醫器輸字第029749號
中文品名:瑞絲朗-丰采(含利多卡因)|英文品名:Restylane Volyme
使用前請務必詳閱原廠之使用說明書並遵照指示使用
組成:
- 玻尿酸(Cross-linked hyaluronic acid):20 mg/ml
- 鹽酸利多卡因(Lidocainehydrochloride):3 mgml
- 生理緩衝液pH7(Physiologicl bufferpH7):含量足以調製1毫升
- 交聯度:5-8%
產品敘述:
Restylane Volyme 為無菌、生物可收、非動物來源的交聯玻尿酸且添加3mg/ml鹽酸利多卡因的透明凝膠。凝膠預填充於一塑膠針筒中,針筒內容物經過濕熱滅菌。針劑和2支27GX/2"超薄壁的針頭以泡殼分別包裝針頭經過放射線滅菌,本產品僅限單次使用,為確保後續追蹤,包裝所附之病患錄標應黏貼於病惠病歷上。
適應症:
本產品可用於加強臉部組織的飽滿程度本產品建議用於矯正部體積,例如:臉頰和下巴,根據將治療的區域與組織支撐力,本產品應該注射於骨膜上區域(supraperiosticzone)或皮下組織。配方中添加Lidocaine到產品中用於少治療注射时所造成的疼痛。
作用機制:
本產品增加組織體積以達到恢復臉部肌膚輪廓到理想的程度。填充和支撐的效果來自於交聯後玻尿酸結合水的能力。
在全臉矯正臨床試驗中使用於臉頰體積矯正,於最後一次注射後6個月有909%的受試者仍有改善,另在一個臨床試驗中,注射於下巴、太陽穴、臉頰、骨部位,有68.3%患者可維持效能達18個月。
禁忌症:
- 對玻尿酸過敏者或以蘊胺類局部麻醉者
- 紫質症者(先天性新陳代謝異常)
警告:
注意事項如下所示:
- 不可注射於靠近急性疾病例如:發炎、染或腫瘤的治療部位。
- 不可以血管内方式注射。其他可注射式的醫療器材,無意注射入或靠近血管可能會導致血管阻塞或收縮,形成局部缺血或壞死。
- 不可注射到出血異常或正在服用抗凝血藥物的患者。
- 不可注射到已經有非玻尿酸的植入物之區域。
- 勿重覆滅菌。
- 勿與其他產品混合使用。
- 透明質酸與四紐銨鹽化合物(例如benzalkoniumchloride)不相容,因此,本產品勿與四級銨鹽接觸或接觸任何曾經接觸過四銨鹽之醫學手術器具。
- 本品多次重複使用後形成亚瑟氏反應(Arthus Reaction)的機率不明。
不良事件:
- 病惠必須被告知關於注射過程及使用本產品的潛在風險和不良事件。
- 下列上市後不良事件已經被記(非詳細清單):血管性水腫、萎縮疤痕、水泡、瘀傷、微血管異常例如微血管擴張、皮膚變色、紅班、過赦、硬化、染、發、血/壞死、結塊、神經症狀例如感覺異常、疼痛/痛、/結節、搔癢、皰疹病毒感染再次活化、短時間作用的如水腫和蕁麻疹。
- 一般注射玻尿酸凝膠和使用本產品可能發生的其他潛在的不良事件已經被記錄於如下:膜腫、痤瘡、產品移位(device dislocation)、管(fistula)、肉芽腫、皮疹和視覺障礙。
- 與注射相關的不良事件例如:瘀傷、紅斑、搔癢、水腫、疼痛/觸痛通常於注射後一周內自動痊癒。
- 無意的血管內注射可能導致血管損傷或植入其他可植入的產品可能導致血管收缩缺血或死可能表現在植入部位或受影響的血管所供應血液的區域,或極少可能因為栓塞而造成其他器官缺血。部美容治療有少數報告顯示,缺血影響眼睛而導致視力喪失,且影響大腦造成顧內阻塞注射鼻子後,可能發生缺血壞死,尤其是先前隆鼻過的病患。
- 有報告顯示植入部位的發英症狀出現於注射後不久或延長至數週。由於不恰當的感染治療可能導致併發症,例如:化膿,所以如發生原因不明的感染,應排除為不良事件,必要時需進行治癒。且不建議口服類固醇而不合併抗生素治療。如發生持續或復發性的發炎症狀,考慮以抽吸/排出、擠壓或酵素降解(使用已被科學文獻所佐證之玻尿酸降解酶)來移除本產品。在執行任何移除程序前,為了方便觸診,可以NSAID治療2-7天或服用皮質類固醇小於7天來減低水腫情形。
- 曾經有醫療上重大不良反應的病惠,重複治療時,需將先前反應的嚴重度列入考量。
- 請聯紫當地Galderma 代表或代理商通報本產品的不良事件。
使用注意事項:
注射式醫療器材一般注意事項:
- 為了避免穿刺或擠壓到血管、神經和其他脆弱的結構,對於治療部位具解剖學上的知識和特別注意是必要的。
- 注射過程可能有感染的風險。無菌技術與標準规範防止交叉感染是必要的。
- 當治療區域由於缺血風險升高而需使用限制性的輔助循環系統時,需特別小心。
- 當治療的臉部區域僅有少量的軟組織支撐或軟組織覆蓋,例如:眼眶周圍,需特別小心以避免明顯的腫塊。
- 黑眼圈(pigmented dark lower eye lid circles)、皮膚薄和容易水腫的病惠不適合注射於下眼眶區域(lower periorbital region)。
- 使用免疫抑制劑的病惠也不適合治療。
- 容易形成增生性疤痕(hypertrophic scars)或其他癒合異常的病患,需特別小心治療。
- 注射過程可能導致潛在或非顯性的皰疹病毒感染再次活化。
- 正在服用阿斯匹靈、非固醇類抗發炎藥(NSAID)等影響血小板功能的患者,可能會因注射而增加該部位的瘀傷或出血。
- 對治療結果存有過度期待的病人不適合使用本產品。
- 如果發現包裝損壞,請勿使用。
- 假如針內容物呈現混濁時,請勿使用。
使用本產品的特別注意事項:
- 本產品不適用注射在骨膜上區域(supraperiosticzone或皮下组織以外的部位。
- 當同時使用利多卡因在牙科麻醉或局部給藥時,所給予的總量必須列入考量。高劑量的利多卡因(超過400mg)願現影響中框神經系統和心臟傳導的急性中毒症狀。
- 由於全身性毒性加成,所以當病惠接受其他局部麻醉劑或蘊胺類相關麻醉劑,例如:某些抗心律不整藥物,需特別小心。
- 使用利多卡因在具有癲痛、心臟傳導受損、肝功能嚴重受損、或嚴重胃功能不全的患者身上需特別小心。
- 假如本產品的注射深度太靠近表皮,這可能導致可見的腫塊和/或呈現淡藍色。
- 在任何局部發炎反應消失前,患者必須避免讓治療部位接觸高溫(日光浴、三溫暖、蒸汽浴等)或極度低溫。
- 若雷射治療、化學换膚或其他使皮膚刺激的程序在本產品的術後執行,有導致在植入部位引起發炎反應的風險這也適用於若施打本產品前,皮膚已施打其他產品並完全意合。
- 在每次療程的每個治療部位,最大建議使用量為2ml,本產品單一療程最大建議總注射劑量為10ml,而實際注射劑量由醫師診斷評估。
- 本產品尚未於懷孕或哺乳中的婦女進行測試。
- 勿使用於孩童。
- 本器材之使用須符合「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」之规定。
許可證仿單證照:

適應症 / 使用禁忌 / 警告事項:

泰奧賽恩
Teoxane
TEOSYAL / 俗稱:緹奧希 玻尿酸
中文品名:泰奧緹塑玻尿酸|英文品名:RHA 4 Implant 衛部醫器輸字第033916號
中文品名:泰奧緹盈玻尿酸|英文品名:RHA 3 Implant 衛部醫器輸字第034000號
中文品名:泰奧緹希玻尿酸|英文品名:RHA 2 Implant 衛部醫器輸字第033917號
產品敘述:
本產品為一種具有黏彈性、無茵、廡熱原、透明無色丶均質且可生物降解的凝膠植入物,由馬鏈球茵(streptococcus equi)發酵取得的濃度23 mg/ml 透明質酸鈉(NaHA)及交聯劑(BDDE)祖成,並溶於生理緩衝溶液(pH 7.3) 中。本產品也包含0.3%鹽酸利多卡因以減少注射時疼痛。 TEOSYAL 系列含 RHA2 、RHA3 、RHA4 三型號產品,三者交聯程度由低至高分別為 RHA2 、RHA3 、RHA4。
適應症:
本產品適用於注射到深層真皮層至皮下徂織,用於矯正22 歲或以上成年人之法令紋(NLF)。
注意事項
- 為了盡量減少潛在併發症的風險,本產品應僅由合格且經完整訓練之醫師使用,他們接受過注射技術的適當培訓,並且對注射部位及周圍的解剖構造有所了解。
- 應鼓勵醫護從業人員在治療前與病患討論軟組織注射的所有潛在風險,並確保病惠了解潛在併發症的前兆和症狀。
- 除了預期使用/應症中描的治療外,解剖區城的安全性及有效性尚未在受控的臨床研究中被證實。
- 豐唇的安全性和有效性尚未證實。
- 如所有經皮手術一樣,真皮填充物的植入具有感染風險,應遵照與注射物質相關標準注意事項。
- 對免疫抑制治療的患者應慎使用本產品。
- 本產品注射部位可能出現瘀傷或出血。對於使用可延長出血的試劑(如血栓溶解劑、抗凝血劑或血小板凝集抑制劑)的患者,應謹慎使用本產品。
- 注射本產品至先前有皰疹性皮疹病史的患者,可能會引起皰疹復發。
- 使用本產品治療後進行雷射治療、化學換膚或基於活性皮膚反應的任何其它程序,可能會在植入部位引起發反應的風險。皮膚在經過上述程序後,尚未修復完全之前,也可能發生相同的風險。
- 本產品應按照供應的方式使用。在使用說明外修改或使用本產品,可能會對產品的無菌性、安全性、均質性或功能性產生不良影響。
- 本產品是包裝單一病惠使用。請在兩項治療及/或兩位病惠間重複使用注射器請勿重新滅菌。請勿分装使用。
- 若包裝已開或損壞,請勿使用。若無法遵守此注意事項,則無法保證產品的無菌性。未遵守針頭安裝說明可能導致魯爾鎖和針座連接處的針頭脫離和/或產品洩漏。
- 本產品是一種透明、無色的凝膠,不含顆粒。若注射器內容物出現分離現象和/或混濁,請勿使用。
使用禁忌:
- 本產品禁止用於嚴重過敏的患者,具有過敏史或病史或存在多個嚴重過敏史。
- 本產品含有微量的革蘭氏陽性細菌蛋白,對此類物有過敏史的患者禁用。
- 本產品不應用於先前對蘊胺類局部麻醉劑過敏的患者,如利多卡因。
- 本產品不應用於出血性疾病患者。
- 本產品禁用於任何軟組織支持或軟組織包覆量有限的部位,例如眉間、前額、鼻部及眼眶周圍(如眼圈、眼瞼、魚尾紋等)的注射。
- 本產品禁用於已知有蟹足腫形成、肥厚性疤痕、色素沉澱的敏感性患者。
- 本產品禁用於周圍或治療區域出現發炎或感染類型皮膚問題(痤疮、皰疹等)。
- 本產品禁用於治療部位存在其它植入物(包含永久性植入物的情况。
- 本產品禁用於懷孕期間、哺乳中的女性和22歲以下的患者。
警告:
- 本產品不可注射至血管。若將本產品注射至血管系統可能導致栓塞、血管阻塞、局部缺血或梗塞,造成组織死與失明等併發症。注射軟組織填充物時須格外小心,如緩慢注射產品並施加所需最小壓力。已經報導過在臉部血管內注射軟組織填充物相關的罕見但嚴重的不良事件,包含暫時性或永久性视力障礙或失明、腦缺血或腦出血導致中風·皮膚壞死、及臉部下方结構損傷若患者出現以下任何症狀,請立即停止注射:視力改變、中風跡象、皮膚變白或手術過程中或手術後不久出現異常疼痛。若不慎注射至血管內,病患須及時接受醫療照護,並且可能由適當的醫護從業人員専家進行評估。
- 在特定部位使用產品,其存在活性發炎反應(皮膚出疹,如囊腫、丘疹、皮疹或麻疹)、感染或皮膚損傷,應延遲到潛在反應得到控制。
- 治療部位反應主要為短期發症狀(如腫脹、發紅、壓痛或疼痛),通常在14天內可消退詳細資訊請參閱不良事件章節。
- 已經報導過在使用真皮填充物後會出現發炎反應、過敏反應、水腫、植入物移位、座、水泡、疤痕形成,丘疹及遲發性肉芽腫。
- 本產品多次重複使用後形成亞瑟氏反應(ArthusReaction)的機率不明。
- 透明質酸已知與四銨鹽不相容。
- 玻尿酸植入物禁止於全身麻醉下使用。
台灣衛生福利部醫療器材許可證:



適應症 / 使用禁忌 / 警告事項:












ELLANSÉ™:洢蓮絲(俗稱少女針)|衛部醫器輸字第026659號
中文品名:洢蓮絲植入劑|英文品名:ELLANSÉ|市場俗稱:少女針
ELLANSÉ洢蓮絲(俗稱少女針)核准之效能為:ELLANSÉ-S可為中度至重度臉部皺紋及其他不 美的結締組織或狀況做暫時性(意指:可被人體所吸收式)的修正,ELLANSÉ-S利用身體的發炎反應來包覆微粒子並刺激結締組織的生長,由於此微粒子可被身體完全吸收,結締組織的生長會在幾個月內完全取代注入的膠狀載體。
使用前請務必詳閱原廠之使用說明書並遵照指示使用。
產品說明:
ELLANSÉ-S是一種滅菌,無乳膠,無熱原因子,可全部吸收,非永久性的植入體,他的主要成分是合成的Poly-e-Caprolacton(PCL)聚-E-已內酯微粒子,懸浮於一種磷酸鹽緩衝(PhEur),甘油和Carboxymethylcellulose(USP)的膠狀載體中。ELLANSÉ-S的粒子範圍大小在25-50microns,該要用27號針頭來注射。
產品規格/型號:
- ELLANSÉ–S/M(0.5ml及1ml)
- 每盒含2支Syringe(0.5ml或1ml及4支27Gx 34針頭
主要用途/適應症:
ELLANSÉ-S 可為中度至重度部紋及其他不完美的結締組織或狀況做暫時性的修正,ELLANSÉ-S 利用身體的發炎反應來包覆微粒子並刺激結組織的生長,由於此微粒子可被身體完全收,結締組織的生長會在幾個內完全取代注入的膠狀體本產品單次療程適用劑量值為1m。本產品2年以上長期使用之安全性及有效性未經實。
作用機轉:
ELLANSÉ-S 可由27針頭射植入於皮下或及深部真皮部位,它的微粒子均勻分佈,適合用於凹陷皮膚之填補。
適用部位:
- 鼻唇溝
警告事項:
- ELLANSÉ-S只適用於皮下或深皮下注射。
- 避免淺表注射。
- ELLANSÉ-s包裝是供單一病人使用。重複使用會增加感染風險及降低其效果。
- 假如包裝被打開或損壞則不可使用。
- 對於發炎反應的部位(皮膚出疹子如囊腫、面皰、疹子、或蕁麻疹)或有感染的部位,ELLANSÉ-S的使用應延期至發炎反應已被控制後。
- 應特別小心避免注射進人血管。輸入血管分部內可能會封閉血管和可能引起梗塞或栓塞。據報告指出,這樣的情況可能會出現在嘴唇、鼻子、眉眼或眼周。
- 不要過度注射需要矯正的部位。
- ELLANSÉ-s不可被注射於嘴唇朱紅部位或嘴唇潮濕黏膜處。
- 不可再滅菌。
- 假如注射針筒的尾端帽套或注射針筒的推不在位子上不可使用。
- 注射過程的反應包括發紅、腫脹、疼痛、癢、瘀傷或壓痛可能發生在注射處。這些狀況通常會在注射後七天內自然消失。
- 與任何其他的植入劑一樣,可能出現的不良反應包括:敏感、過敏反應、發炎、感染、瘻管形成、血腫、積液、突出、硬結形、不當癒合、皮膚變色、不當或過多的增大、矯正損失、若注射於血管內影響局部血流及造成血管裂傷、阻塞、塞或栓塞,及植入處之農腫可能造成硬結和/或疤痕的形成。
- 經報導臉部注射療程相關嚴重但罕見的不良反應﹐包含暫時性/永久性視覺損傷、失明、腦部缺血/腦出血、導致中風、皮膚壞死和對臉部組織結構的損傷。
- 患者若出現下任何症狀,請立即停止注射視力的變化、中風的跡象、皮膚變白、在療程期間/療程後感到不尋常的疼痛。
- 小結節或肉牙腫可能形成並需要治療或移除。
- 每當醫事人員使皮膚植入劑做治療時,醫事人員必須已接受過避開注射高風險區域以及如何避免嚴重併發症,如:誤植入血管(Rzany2015)相關培训。雖然這樣的事件是罕見的,若不幸發生時,醫事人員應該有相應的治療方式來處理這樣的狀況。
- 如果遇到血管阻塞的情況,可使用的治療方式是高壓氧和妥善的傷口照。注意:如果診所沒有相關的設備及這些治療方式,那麼醫師需與最近的醫療機構進行治療的安排。
- 如任何的醫學療程,除上述不良事項外,其他的不良事項也可能發生。
使用禁忌:
- 禁使用在有過敏性病史而有嚴重的過敏顯示的病人,或者有多種嚴重的過敏性存在或病史。
- 不可使用在對任何成分會產生過敏的病人。
- 不可被使用在急性或慢性皮膚疾病的部位(炎或感染)。
- 不可被使用在有瘢瘤形成和肥厚疤痕體質的病人。
- 不可被使用於正在接受可體松治療的病人,因為此治療會抑制結締組織纖維的成長。
- 不可被使用於前做過加大手術部位,尤其是曾經植入永久性植入劑的部位。
- 不可被使用在靠近眼周附近的部位(眼皮、黑眼圈、魚尾紋)或眉間,因為可能會有眼部缺血導致視力喪失的風險。
注意事項:
使用時應注意以下事項:
- ELLANSÉ-S應僅醫護人員在熟悉此產品及使用說明後,專門技術注入矯正的量。
- 清理並消毒注射部位,以避免炎或感染。就如其他的注射劑,正在使用抗凝血劑的病人,可能在注射處會有血腫或局部出血的問題。
- ELLANSÉ-S和其他的藥物、物質或植人物的交互作用尚未有研究。
- 與其它所有的經皮膚療程一樣,ELLANSÉ-S植入劑有感染的風險。關於注射前的標準注意事項應該被遵守。
- 懷孕、哺乳或18婦女使用ELLANSÉ-S的安全性尚未確定。
- 使用能夠延長出血的藥物,如阿斯匹靈或沃法令阻凝劑的病人,當使用任何注射時,在注射的部位可能經歷瘀傷增加或出血。
- 使用後,治療的注射針和針頭有潛在性的生物危險。應依照醫學常規及政府規定廢棄尖銳物管理和處理。
- 病人應被告知,在治療後約2小減少治療區暴露在大量的陽光下、紫外線燈、與極冷的氣候裡,直到任何最初腫或發紅已經消散。
- 若在使用 ELLANSÉ-S後進行雷射治療、化學脫皮、或任何其積極皮反應的療程,可能有機會在注射部位引起發炎反應。同樣的情況也可能發生在這些療程後,在皮膚尚未完全癒合前使用ELLANSÉ-S時。
- ELLANSÉ-S已裝在針筒中並可立即使用在使用此產品時,不可將ELLANSÉ-S其的皮膚填充劑或神經毒素產品混合使用。
- 檢查注射的皮膚層別是否正確。認不是在血管注射(疼痛、針頭有血液)。僅使用小劑量並緩慢的注入。
許可證仿單證照:

適應症 / 使用禁忌 / 警告事項:



SCULPTRA:舒顏萃|衛署醫器輸字第021227號
中文品名:舒顏萃植入劑|英文品名:SCULPTRA Poly-L-Lactic acid
增加臉部凹陷部位的體積及改善皮膚的凹陷,特別是不同凹陷程度的鼻唇溝、皮膚皺摺及皺紋。改善HIV病人臉部大體積的皮膚脂肪流失(脂肪組織萎縮)。
使用前請務必詳閱原廠之使用說明書並遵照指示使用。
產品說明:
SCULPTRA 是一種聚左孔酸(poly-L-lacticacid)的植入物,無菡、非熱原性之懸浮液,它是藉由將無值注射用水(歐洲菓典規格)加入蕪菌乾粉調醚而成。此懸浮液中含有聚左孔酸(poly-L-lacticacid)的微粒,即聚乳酸(polylacticacid)的結晶型,聚左乳酸(poly-L-lacticacid)具有生物相容性及生物可分解性,它屬於a羥基峻系列(alpha-hydroxy-acidfamily) 的合成聚合物。
SCULPTRA的成分,每個小瓶中含有:
- 聚左孔酸(Poly-lactic acid)
- 羧甲基纖維素鈉(sodiumcarboxymethylcellulose)
- 非熱原性的甘露醇(Nonpyrogenicmannitol)
主要用途/適應症:
SCULPTRA可以增加臉部凹陷部位的體積及改善皮膚的凹陷,特別是不同凹陷程度的鼻唇溝、皮膚皺摺及皺紋。SCULPTRA也可以用於改善HIV病人臉部大體積的皮膚脂肪流失(脂肪維織萎縮)。
禁忌:
考治癌部拉胤圍才,急漼式侵漼沒J/疾病(成染式痊災),則請笏俁甩SCULPTRA。對SCULPTRA 矽在有成分過級考,泰止促甩本篦拗。
警語:
SCULPTRA 只可注射於皮下組織或深層真皮部位。為了避免因不良的注射技術(皮膚表層注射、注射過量、調配方式不正確)所引起早期丘或結節,應避免注射 SCULPTRA在皮膚表層。此外要按摩治療部位以確保植入劑分均勻,可以减少注射部位出現丘疹或結節。
為了避免污染,注射小瓶只能供單一病人使用,注射小瓶不可再次消毒使用·若 SCULPTRA 的包裝或小瓶已打開或破損,請勿使用。
應小心避免注射至血管,注射入血管可能阻塞血管導致皮膚梗塞或栓塞。
SCULPTRA 的治療效果在數星期內會出現,輪廓的校正應該逐漸改善,應避免過度矯正。
請勿注射在嘴唇的紅色部位。
粉末應使用無菌注射用水混合之(無菌注射用水:符合歐洲藥典的規定)。
注射 SCULPTRA,應使用26號針頭及單次使用的無菌針筒。
注意事頊:
注意事項如下所示:
- SCULPTRA 只可由知道如何矯正體積缺(volumedefect的專業醫師,在充分了解本產品及其使用方法後,使用之。注射部位應無發英或感染並應以消毒劑清潔之。
- 就像所有的注射一般,接受抗凝血劑治療的患者,其注射部位可能會有發生血腫及局部出血的風險。
- SCULPTRA尚未被證實是否對懷孕、哺乳婦女或18歲以下的病人無害。
- 目前尚無SCULPTRA與物或其他物質或植入劑的交互作用研究。
- SCULPTRA應小心使用在皮膚薄的部位,例如眼窩周圍部位,在眼窩周圍部位植入SCULPTRA有增加丘疹或結節的危險(請參考
副作用
欄,注射技巧請參考本產品的訓練手冊。 - SCULPTRA使用於容易形成蟹足腫和增生性疤痕的患者之安全性尚未建立,不可使用於會形成蟹足腫的患者。
- 在最初紅腫消失前,應提醒病人量避免治療部位的過度日曬或紫外線燈光照射。
- SCULPTRA治療後若要進行雷射治療或、化學性換膚或其他有活化皮膚應的療程時,可能有誘發植入部位發党反應的危險。此風險亦可能發生在上述療程後但皮膚尚未完全復原就進行SCULPTRA治療的情形。
不良反應:
臨床試驗,上市後副作用通報及文獻報告之不良反應被認為可能和注射聚左乳酸相關者,不良反應詳列如下:
- 注射部位之不良反應、注射部位出血、注射部位疼痛、注射部位硬節、注射部位腫脹
- 免疫系統之不良反應、過敏性血管水腫、皮膚結節病
- 感染、注射部位感染(包括臉部蜂窩組織英、金黃色葡萄球菌感染)、注射部位膿瘡
- 皮膚及皮下組織的不良反應、淤血、血腫
- 注射部位萎缩、皮膚增生
- 注射部位蕁麻疹
- 毛細血管擴張症
- 皮下丘疹,看不到但可觸摸感覺到的結節,為無症狀的。
- 看得到的結節,包括眼眶周圍的結節,可能併有發或變色。使用適當的技巧可減少早期(治療後3~6 星期內)發生結節的機率(請參考”語”欄)。
- 注射部位有可能延遲發生皮下結節(在注射後1到14個月),有時延運發生的時間可長達2年在某些個案,皮下結自發性的消除或使用皮質類固醇施以結節內注射治療。若結節體積過大或 發生在困難的部位(如下眼脫),且進行其他治療後仍持續存在,此時可能需要進行手術切除結節。
- 肉芽腫
- 疤痕
- 皮膚變色
許可證仿單證照:

適應症 / 使用禁忌 / 警告事項:



AestheFill:艾麗斯|衛署醫器輸字第021227號
中文品名:艾麗斯皮下填補劑|英文品名:AestheFill|市場俗稱:百變童顏針/精靈針
來自韓國1於2014上市,是一種使用PDLLA(聚雙旋乳酸)成份的膠原蛋白促進劑,運用多孔性微球體結構,注射後不僅有即時性的填充效果,並可誘導促進第一型膠原蛋白增生的填充劑。其主要成分為聚雙旋乳酸PDLLA2是一具生物相容性及生物可分解、代謝的物質,而「PDLLA」(聚雙旋乳酸)更已由美國FDA核准使用於醫療用途,通過衛福部核准國內上市使用。
使用前請務必詳閱原廠之使用說明書並遵照指示使用。
產品用途:
本產品為注射填充物適用於鼻唇溝皺褶的矯正。
警告及注意事項:
A.警告事項
- 本產品僅能注射於較深的真皮層或皮下組織。
- 如同其他藥物注射一樣,在接受抗凝血劑治療的患者,在注射部位可能出現血腫或局部出血。
- 為防止射部位出現早期丘疹或結節,請勿將本產品注入皮膚淺層。
- 如不慎將本產品入血管將可能導致血管堵塞或栓塞。
- 為防止汙染,每一支產品只能用於單一惠者·本產品為一次性滅菌產品,如包裝已拆開或溶解後請勿再次使用或重複滅菌。
- 如果外包裝損或外觀異赏时請勿使用本產品。
- 不可使用本產品於核准適應症範圍之外。
- 請務必在手術前按照溶解方法將本產品完全路解後再使用。
- 請使用一次性無菌25G的注射針或套管。
B.針對使用對象年齡、性別以及健康狀況的特別注意事項
- 請勿將本產品注入患有急性或慢性皮膚疾病(發炎或感染)患者的皮膚組織周圍。
- 對本產品及其成分過敏的患者不可使用本產品。
- 對易患增生性療痕、色素沉澱和肥大性療痕的患者使用本產品其安全性未經證實。
- 對有泡疹病史的惠者注射本產品可能引起復發。
- 有凝血或肝功能障礙的患者不可使用本產品。
C.潛在不良反應
- 1.注射部位反應
- -出血
- -疼痛
- -硬結
- -腫脹
- 2.免疫系統異常
- -過敏性血管性水腫
- -皮膚結節病
- 3.發炎和感染
- -注射部位染包括面部蜂窩組織炎
- -金黄色葡萄球菌感染
- -注射部位膿瘡
- 4.皮膚及皮下組織不良反應
- -瘀血
- -血腫
- -注射部位萎縮、皮膚肥厚症
- -紅斑
- -蕁麻疹
- -毛細血管擴張
- -肉芽腫(本產品自2014年4月於韓國上市,至2018年7月共約16000惠者使用,其中6例呈現肉芽腫反應。)
- -疤痕
- -皮膚變色
- -皮下丘疹,可以觸摸感覺到但觀察不出且無症狀
- -治療後產生結節,包括可以看見眼部周圍的結節,可能伴有發英或變色。注射後初期皮下出現的結節可經由足夠的稀釋與注射技巧而最小化。
- -皮下結可能延發生(注射後114個內),有時延長達兩年。如果必要可自願手術去除結節或使用類固醇治療。
- -肉芽腫
- -疤痕
- -皮膚變色
D.一般注意事項
- 本治療手術必須由受過完整專業訓練的醫師執行。
- 手術前師應向患者充分說明本產品的適用症狀、禁忌事項、潛在副作用等。
- 使用前請務確認滅菌狀態未發生損壞或汙染。
- 請確認產品的保存期限。
- 注射部應先使用消毒紗布清潔,並無發英或感染現象。
- 患者須注意可能避免注射部位曝露於陽光或UV光線,直到初期注射出現的浮腫與發紅消失。
- 本產品治療效果須經過幾周時間慢慢顯現,同一部位應避免過量注射。
- 感染或發英情況得到控制後才可使用本產品。
- 本產品對於豐唇的安全性及有效性尚未經證實。
- 本產品務必與無菌蒸館水合後才能注射使用。
- 臨床研究期間以外長期使用本產品的安全性及有效性未經證實。
E.相互作用
- 本產品與其他藥物、成分及植入物之間相互影響尚無相關研究。
F.孕婦、哺乳期婦女、未成年及高齡者的使用
- 孕婦、哺乳期婦女、18歲以下未成年者的使用其安全性尚未經研究證實。
G.其他注意事項
- 如不慎注進血管的話有可能導致失明等嚴重後果。強烈建議不可使用本產品於眼窩四周、較薄的皮膚組織和可能注入血管的部位。所以在治療時要特別小心。
- 當皮膚較薄的部位進行注射、過量注射或溶液調配方式不正確都有可能造成丘疹或結節生成的風險。可藉由對注射部位輕柔按摩減少皮下丘疹或結節的生成以均勻產品分布。
- 請勿將本產品注入嘴唇部位。
- 請勿將本產品注入血管,以免引起血管堵塞和組織壞死。
許可證仿單證照:

適應症 / 使用禁忌 / 警告事項:

水無痕玻尿酸 (市場俗稱) 衛部醫器輸字第022219號
中文品名:保柔緹
保柔|英文品名:BELOTERO Balance
產品用途:
本產品是一可吸收之注射植入物,用來增加肌膚組織的體積,可以:
- 矯正由於受傷、年紀因素所造成的臉部凹陷
- 臉部輪廓重塑如臉頰、下巴
- 豐唇(嘴唇紅色邊緣部份,增加立體弧度)
- 治療中、深度的法令紋
使用前注意事項:
- 治療前必須先告知患者關於本產品的禁忌症及可能的副作用。
- 請勿將本品用於皮膚組織填充之外其他的適應症。
- 由於缺乏在有活動期自身免疫疾病或有家族史的患者中注射本品的耐受性和有效性的臨床數據,醫生必須根據疾病的性質和相關治療,根據每個病例的情況判斷是否執行注射。
- 我們建議對這類患者進行一個預先雙重檢測,如果疾病有所進展則不能進行注射,我們還建議注射後對這些患者進行仔細的監測。
- 不建議有鏈球菌感染病史或易誘發肥性疤痕或痴痕疙瘩的患者注射本品。
- 無预先培訓前,不建議將本品注射至眶周區。像所有填充劑一樣由於注射至這一敏感區域可能導致度組織壞死,眉間區域注射時應非常謹慎。
- 本品不能與其他美容醫技術,如去皮、皮膚磨削術聯用,也不能與任何類型治療聯用,或在其完全癒合早期使用,在所有情況下,即使癒合發生較早,距上次治療後兩周內不能再使用本品,尚無臨床數據證實本品可與上述治療及“安堤斯”系列以外的其他填充產品聯用尤其不应注射於先前已注射永久或半永久填充劑的部位。使用前檢查內包裝的完整性及確認注射器及注射針的有效期限。請勿使用已過期或包裝打開或破損的產品。
- 針對敏感的肌膚可以預先使用局部麻醉的貼片或藥膏處理。必須注意麻醉可能導致局部紅腫或過敏。
- 服用抗凝藥物,如阿斯匹林或非類固醇抗炎藥物的患者,注射部位血或出血反應可能加劇。
- 不可將本產品换裝到另一個容器,且勿在產品中增加其他成分,僅凝膠是無菌的,注射器外部並非無菌。
- 本品不應與未經Merz推薦的自動注射系統併用,如果採用自動系統,醫師應有使用該系統的資格,且使用前閱讀系統使用說明。建議僅採用產品包裝中提供的針頭。
- 本產品為一次性使用的產品,使用後丢注射器及剩的產品。不可再滅菌、重複使用。
- 患者在治療後至少12小时避免使用化妝品且治療後2周內避免蒸汽浴、土耳其浴及陽光或紫外線長時間曝曬。患者同樣必須避免壓或觸摸臉部治療過的區域。
使用禁忌:
本品禁用於:
- 對本產品的某一組成成份有嚴重過敏者,特別是玻尿酸
- 自體免疫疾病和糖尿病患
- 常反覆發作的喉嚨痛
- 急性關節風濕病
- 遺傳性出血心內膜炎
- 易患蟹足腫的患者
- 孕婦或哺乳的婦女
- 18歲以下年輕人
- 不可將本產品注射在血管內
- 不可將本產品注射在眼睛周圍部位(眼圈四周、眼皮、魚尾紋、皺紋)及表淺紋
- 本產品不可用於豐胸
- 本產品不可用於骨頭,肌腱或韌帶或肌肉
- 本產品不可與其他醫學美容技術合併使用,如脫皮、疤痕磨皮或任何型態治療,在剛結束本產品治療後。在所有的情況下,就算治療恢復的較,也不可以在最後一次治療兩週內再次使用本產品。沒有任何的臨床實驗證實本產品可結合上述的醫學美容技術。
副作用
治療前應先告知患者可能發生的副作用。注射时可能合引起非常輕微地出血,不過出血會隨著注射結束自然地消失。有時出現單一或多者以下副作用,不是立即就是遲的反應(該清單可能不完全):
- 局部浮腫或輕微紅斑,有時伴隨著治療部分的刺痛感,這些反應也許會持續一週以上,醫師才能開立處方適當治療患者。
- 注射部位紅腫或結節。
- 對產品成份的過敏反應,特別是玻尿酸鈉。
- 治療區域變色惠者被告知要通知醫師如果副作用持續一週以上,醫師才能開立處方適當治療患者。
應告知患者,向他/她的醫師報告任何持續超過一周的不良反應,醫師隨後可以開立處方適當治療患者。
不良反應
這些不良反應包括植入部位的腫脹和硬化,有時在植入部位的周圍組織有水腫的現象。也有可能產生紅斑、壓痛和罕見的座狀丘疹。
這些反應可能在植入後立即產生,或是延至2到4週後才生,它的程度只有輕微到中等,並且會在2週內自癒。
這些反應絕大多數都屬於輕微或溫和的,持續時間短暫(7天或更短)·患者應被告知要通知醫師如果不良反應持續1週以上,醫師才能開立處方適當治療患者。





如何選擇專業的醫師和正派經營令人心安的診所來進行醫美療程 是ㄧ項很重要的課題,減少醫美風險,就診前確認高品質通行證,米蘭時尚診所擁有下列優勢:
- 通過衛福部醫策會舉辦的美容醫學品質認證,
- 透過英國ISO9001驗證來強化各個療程的風險控管,
- 堅持使用許多高成本的原廠合法儀器和耗材,
- 建立標準作業流程,不斷的內部教育訓練,
- 長期在整形外科、醫學美容界樹立優良典範,


- 醫療風險:侵入式手術造成開放式傷口,術後有傷口照護不當或其他因素所造成之傷口感染風險。更多醫療風險會於與醫師溝通諮詢時,由醫師評估個人情況後告知。
- 禁忌症:懷孕、或療程期間有懷孕計畫、心臟病史、高血壓、嚴重糖尿病、肝腎功能受損、免疫系統異常..等,或其他經醫師判斷不適合此療程者。
- 副作用:術後可能會有短期瘀傷、腫脹或發紅現象,請避免曝露在大量陽光或高熱下。更多副作用會於與醫師溝通諮詢時,由醫師評估個人情況後告知。
以上官網內容為提供衛生教育、醫療知識用途。實際療程效果依據個人體質條件而有差異,本資訊無法替代醫師親自問診,任何療程效果與風險均應以醫師親自診斷為主












